Al-Taleb, M.,
Hassawi, D & Abu-Romman, S.
2011. Production of Virus Free Potato Plants Using
Meristem Culture from Cultivars Grown under Jordanian Environment. American-Eurasian J. Agric. &
Environ. Sci., 11 (4): 467-472.
Abstrak:
Kultur
meristem menjadi sarana yang menjanjikan untuk mengeliminasi virus dari tanaman
yang terinfeksi virus dan berhasil diterapkan pada kentang. Sejumlah 70 kentang
( Solanum tuberosum L.) dari masing-masing
3 kultivar yang ditumbuhkan di Jordan diperoleh dari Kementerian Pertanian, diuji
dengan ELISA untuk mendeteksi adanya infeksi virus. Kehadiran infeksi Potato Virus Y (PVY) yaitu 21,4%
(kultivar Spunta), 15,7 % (kultivar Alaska), 12,8 % (kultivar Safrane). Kultur
meristem diaplikasikan pada kentang yang terinfeksi untuk tiga kultivar
tersebut. Hasil perkembangan tunas dan
akar mengindikasikan bahwa medium yang ditambah dengan 0.5 mg/l IBA (indole
butyric acid) menunjukkan pemanjangan akar yang baik sekitar 9,41 cm, jumlah
tunas sekitar 2,6 dan jumlah daun sekitar 15,40. Hasil Elisa untuk planlet yang
diproduksi secara in vitro menunjukkan bahwa planlet bebas virus PVY. Reverse transcription polymerase chain
reaction (RT-PCR) berhasil diamplifikasi gen coat protein (CP) dari virus PVY dalam sampel yang terinfeksi dan
mengkonfirmasi hasil ELISA. Aklimatisasi planlet yang dihasilkan dari tahap
multiplikasi akar atau tunas secara in vitro terungkap bahwa 90 % pada kultivar
Spunta yang mampu bertahan hidup dan 80 % baik pada kultivar Alaska dan Safrane
yang mampu bertahan hidup.
A.
Pendahuluan
Tanaman
kentang (Solanum tuberosum L.)
merupakan salah satu tanaman pangan penting dunia yang menduduki peringkat ke
empat setelah nasi, gandum dan jagung. Kentang
biasanya digunakan untuk dimakan manusia, sebagai pakan ternak, dan sumber pati
serta alkohol. Kentang sebagai tanaman pangan memiliki kedudukan penting secara
ekonomi di Jordania dengan produksi
mencapai 59230 pada tahun 2010.
Virus
dan viroid adalah sumber penyakit yang umumnya menyerang tanaman kentang. Beberapa yang terkenal yaitu PVY, PVX
dan PLRV. PVY mengakibatkan pola mosaik kuning, hijau muda maupun
hijau tua pada daun, nekrosis pada pembuluh daun maupun akar, serta kematian
pada titik tumbuh. PVX memunculkan gejala yang sama dengan PVY. PLRV
mengakibatkan nekrosis pada margin daun muda sehingga mengakibatkan daun
terkesan menggulung. Kehadiran
penyakit yang disebabkan oleh virus merupakan alasan yang penting yang
menunjukkan penurunan produktivitas tanaman kentang hingga 75%. Sebagai contoh,
PVX sendiri dapat menyebabkan penurunan hasil panen sebesar 15-30%; PLRV dan
beberapa strain PVY mengurangi hasil umbi sekitar 50-80%.
Kultur jaringan tumbuhan di Jordan
telah memberikan bukti kemajuan yang signifikan dalam produksi tanaman bebas
virus.
Jaringan meristem dikenal bebas virus
karena pembuluh xilem dan floem tidak dijumpai pada meristem. Jaringan meristem
berpotensi dalam pengembangan kentang dari tanaman kentang yang bebas virus
dengan penciptaan meriklon. Pada
penggunaan umbi kentang bebas virus, diketahui terjadi peningkatan sebesar 40%
dari hasil panen kentang sehingga penggunaan meriklon diharapkan juga dapat
meningkatkan hasil panen kentang karena sifatnya yang bebas virus.
Teknik
ELISA (enzyme-linked
immunosorbent assay)
menjadi metode standar untuk deteksi virus tanaman dan telah diaplikasikan
deteksi dan identifikasi virus tanaman kentang. Enzim reverse transcriptase pada reverse
transcriptase - polymerase chain reaction (RT-PCR), yang didasarkan pada
deteksi suatu phatogen juga merupakan metode yang sederhana dan digunakan
secara luas untuk mendeteksi virus RNA. Uji RT-PCR mengkombinasikan sintesis
cDNA dan amplifikasi PCR yang telah digambarkan untuk deteksi virus tanaman
kentang seperti PVY, PLRV dan PVA.
Tingginya
biaya pada penyediaan bibit dari umbi, perawatan, penyimpanan dan adanya penyebaran virus secara khusus
menjadi masalah dalam produksi kentang di Jordan. Penelitian ini diharapkan
mampu mengatasi masalah tersebut dengan menghasilkan protokol kultur meristem
yang reproduktif untuk produksi tanaman kentang bebas virus yang dapat tumbuh
di lingkungan Jordanian. Selain itu, penelitian ini juga dilakukan untuk
mengkonfirmasi ketiadaan virus pada meriklon menggunakan teknik ELISA dan
RT-PCR.
B.
Bahan
dan Metode
1. Persiapan
material tanaman
Umbi dari varietas kentang yang
komersial (Alaska, Spunta dan Safrane) dari kementerian pertanian di Jordania
diuji DAS-ELISA untuk mendeteksi keberadaan virus. Umbi kentang yang terinfeksi
virus dipilih dan digunakan untuk produksi bibit.
2. Pembentukan
kultur meristem
Sebanyak 30 bibit yang terinfeksi PVY
dari umbi kentang dari masing-masing varietas digunakan sebagai eksplan untuk
kultur meristem. Tunas dipotong dan disterilisasi dalam 0,1 % hypochlorite dan
3 tetes Tween-20 selama 10 menit, kemudian dilakukan 3 kali pencucian dengan air suling steril. Meristem
pucuk daun primodia dipotong dan diisolasi di dalam LAF menggunakan mikroskop.
Media MS 0 digunakan sebagai medium kultur dasar. Setelah menyesuaikan PH 5,7,
medium di padatkan dengan 8 g/l agar Difco Bacto dan disterilisasi di dalam
autoklaf pada suhu 121 0C selama 30 menit. Meristem yang terisolasi
dengan cepat dipindahkan ke cawan petri steril yang mengandung 10 ml medium MS.
Kultur dipelihara pada suhu 25 ±
2 0C dan dengan 16/8 (fotoperiodik
terang/gelap) dalam ruang kultur. Ukuran meristem yang terisolasi sekitar 0,3
mm.
3. Pembentukan
tunas dan akar
Setelah 4 minggu kultur meristem awal,
10 meristem yang telah berkembang dari masing-masing kultivar disubkultur dalam
medium MS 0, 10 lainnya disubkultur pada medium MS yang ditambah 0,5 mg/l NAA
dan 10 lainnya disubkultur pada medium MS ditambah 0,5 mg/l IBA. Semua
subkultur dikerjakan dengan 15 ml medium MS, pH 5,7 dan ditambahkan 8 g/l Difco
Bacto agar, yang kemudian diberikan pada masing tabung reaksi Pyrex (25x150 mm)
dan telah disterilisasi dengan autoklaf pada suhu 1210C selama 30
menit. Kultur kemudian diinkubasi dalam ruang kultur pada suhu 25± 20C dam fotoperiode 16/8 (terang/gelap), 1 kilo
lux intensitas cahaya disediakan dengan menggunakan lampu fuoroscent putih.
Setelah 5 minggu, planlet yang berkembang diamati untuk beberapa parameter,
seperti panjang pucuk, panjang akar, jumlah daun, jumlah akar dan jumlah tunas.
4.
Aklimatisasi
Planlet
yang telah memiliki akar dari masing-masing kultivar diambil dari tabung reaksi
dan kemudian dicuci dengan air suling yang steril untuk menghilangkan agar yang
menempel. Kemudian planlet dipindahkan ke dalam pot-pot kecil yang berukuran 7
cm yang mengandung 1:1 (peat
moss: perlite mixture) dan ditutup dengan plastik.
Masing-masing pot dipelihara dengan suhu 250C dan fotoperiod (16/8)
terang/gelap selama 4 minggu di ruang kultur. Setelah itu, planlet dipindahkan
ke green house dan diteruskan pertumbuhannya
pada suhu 26± 20C.
5.
Reverse Transcriptase-Polymerase Chain Reaction (RT-PCR)
Sejumlah
RNA diekstraksi dari daun planlet
kentang yang ditumbuhkan dalam green
house, menggunakan
EZ-10 Spin Column Total
RNA Minipreps Super Kit (Bio Basic, Canada). RNA yang
telah diekstraksi tadi digunakan sebagai template untuk sintesis cDNA. Sebuah
fragmen protein selubung PVY dengan ukuran kira-kira 801 bp diamplifikasi
dengan sepasang primer yang spesifik:
·
PVYCPv BamH1 (5’TCAAGGATCCGCAAATGACA
CAATTGATGCAGAGG-3’)
·
PVYCPc EcoR1 (5’-AGAGAGAATTCATCACATGTTCTTGA
CTCC-3’)
Coat
protein (CP) dari PVY diamplifikasi menggunakan sistem
RT-PCR berdasarkan protokol yang ada.
6. Deteksi
Hasil PCR yang diamplifikasi
Faktor kuantitas
10 μl dari masing-masing produk PCR dielektroforesis pada 1 % gel agarosa
menggunakan buffer 0.5X TBE. Hasil PCR divisualisasikan di bawah
transilluminator UV dan didokumentasikan dengan sistem dokumentasi gel (Gel Doc
200, BIO-RAD, USA) setelah pewarnaan gel menggunakan ethidium bromide (0,5
μg/ml). 1 kb DNA ladder digunakan
sebagai marker untuk menentukan ukuran fragmen yang telah diamplifikasi.
7.
Analisis
Statistik
Data yang
didapatkan diolah dengan ANOVA. Least Significant Differences (LSD) taraf 0.05
untuk menilai perbedaan pada karakter yang diamati pada masing-masing perlakuan
medium.
C.
Hasil
dan Pembahasan
Penggunaan uji DAS-ELISA pada awal
persiapan material tanaman menunjukkan bahwa 15 dari 70 buah umbi kentang
(21,4%) dari kutivar Spunta, 11 dari 70 buah umbi kentang (15,7%) dari kutivar
Alaska, dan 9 dari 70 buah umbi kentang (12,8%) dari kultivar Safrane
terinfeksi PVY. Umbi kentang yang terinfeksi dari masing-masing kutivar
tersebut digunakan sebagai sumber eksplan untuk kultur meristem pada medium
bebas hormon sebanyak 30 dari 90 meristem awal yang terbentuk.
Meristem memulai pertumbuhan awal dengan
meningkatkan ukuran dan perubahan warna menjadi hijau terang secara gradual.
Dalam 2-3 minggu, tampak daun kecil. Setelah 4 minggu, 30 meristem kemudian
dipindahkan (masing-masing 10 meristem) ke tiga medium dengan konsentrasi zat
pengatur tumbuh berbeda. Semua planlet kentang yang dikembangkan secara in vitro kemudian diuji DAS-ELISA
seluruhnya bebas dari kontaminasi virus. Hal ini membuktikan bahwa memang benar
plantlet dengan sumber eksplan meristem bebas dari kontaminasi virus.
Planlet yang dikembangkan diamati 5
karakternya yaitu: panjang tunas, panjang akar, jumlah tunas, jumlah akar, dan
jumlah daun. Sumber variasi kultivar, media, dan interaksi antara kultivar dan
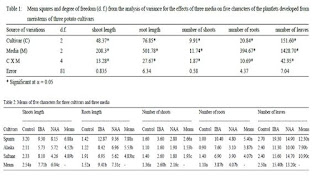
media secara statistik menunjukkan beda nyata untuk semua (5) karakteristik
dalam taraf signifikansi 5% (Tabel 1). Hal ini menunjukkan bahwa masing-masing
sumber variasi menyebabkan adanya perbedaan yang signifikan pada masing-masing
karakter yang diamati.
Pada Tabel 2,
disampaikan hasil pengamatan 5 karakter setelah dilakukan subkultur pada medium
yang ditambah dengan 0.5 mg NAA dan 0,5 mg/l IBA dan MS yang bebas hormon. Baik
NAA maupun IBA merupakan hormon yang termasuk ke dalam golongan auksin. Hasil
yang diperoleh menunjukkan medium MS yang ditambah 0,5 mg/l IBA adalah medium
yang terbaik untuk panjang tunas dengan rata-rata 7,71; panjang akar dengan
rata-rata 9,41; jumlah tunas dengan rata-rata 2,60; dan jumlah daun terbanyak
dengan rata-rata 15,40. Penggunaan 0,5 mg/l IBA merupakan medium yang paling
efektif untuk perkembangan tunas dan akar dari meristem yang dikembangkan awal.
Berdasarkan penelitian
sebelumnya diketahui kultivar Spunta dan Safrane menunjukkan respon yang lebih
menguntungkan untuk pengembangan meriklon daripada kultivar Alaska. Hal ini pun
tampak pada hasil pengamatan pada Tabel 2 yang menunjukkan bahwa rata-rata
nilai kuantitatif dari karakter-karakter yang diamati menghasilkan data bahwa
kultivar Spunta dan Safran terlihat lebih unggul. Sifat-sifat respon kentang
yang berbeda ini berhubungan dengan faktor genetik dari masing-masing kutivar.
Hasil RT-PCR mengkonfirmasi
ketidakhadiran virus PVY dalam plantlet kentang yang dikembangkan melalui
kultur meristem. Primer PVYCPv BamH1, PFYCPc
EcoR1 efisien untuk deteksi PVY dalam
sampel yang terinfeksi akan menunjukkan band pada hasil elektroforesis sebesar
801 bp. Akan tetapi, dari sampel tanaman yang dihasilkan dari kultur meristem
tidak menunjukkan adanya band yang mengkonfirmasi keberadaan virus. Hal ini
sesuai dengan uji DAS-ELISA yang dilakukan di awal.
Aklimatisasi
planlet yang dihasilkan dari tahap multiplikasi akar atau tunas secara in vitro
terungkap bahwa 90 % kultivar Spunta mampu bertahan hidup sedangkan kultivar Alaska
dan Safrane yang mampu bertahan hidup sebanyak 80%.
D.
Kesimpulan
Kultur meristem pada tanaman kentang
bisa menjadi solusi untuk menghasilkan planlet tanaman kentang yang bebas virus
PVY. Hal ini akan mengatasi banyaknya bibit kentang bervirus mengingat bahwa
selama ini kentang lebih banyak dikembangkan dari material vegetatif.